E címmel mutat be a legújabb gyarapodásainkból válogató időszaki kiállítás-sorozat mostantól egy, a Nemzeti Kulturális Alap tavalyi pályázatán elnyert támogatásból vett kapitális méretű fluorit kristálycsoportot. A címet az indokolja, hogy ha az ásvány nem is, de neve sok ember számára lehet ismerős, mint a fluor és a fluoreszkálás névadója. De nézzük csak meg közelebbről, mit is tud a fluorit, hogy nemcsak különböző országok bélyegein szerepel, de az 2018-as év ásványának is megválasztották!
Szerző: Papp Gábor (Ásvány- és Kőzettár)
A fluorit bélyegeken
A fluorit a legjobb formájában
A fluorit a szabályos (köbös) rendszer legmagasabb szimmetriájú kristályosztályába tartozik, de általában csak az osztály legkisebb (hatos) lapszámú formája, a kocka (hexaéder) fejlődik ki rajta. Gyakori uralkodó formája az oktaéder is – mely nevének megfelelően nyolclapú –, ennek klasszikus példáját jelentik az alpi telérek rózsaszín fluoritjai. Nem véletlen, hogy a képen látható, többnyire fluoritkockákat ábrázoló bélyegek közül a svájciak a kivételek a maguk oktaédereivel. A fluoriton azonban kristályosztályának további öt alapformája is megjelenhet, beleértve azt a 48-lapú formát, melyről Móra Ferenc a „Tetrakontaoktaéderek” című bájos novelláját írta – bár ezt a mineralógusok ma már a hexakiszoktaéder névvel illetik. Amint egy a fluorit kristályformáiról megjelentetett gyönyörű album képei is tanúsítják, ugyanazon a kristályon nem ritkán több forma is kifejlődhet. Az ilyen kombinációk egészen gömbszerű megjelenésűek lehetnek (sőt, ténylegesen gömb alakú kristályhalmazok is léteznek). Akinek ennyi jó kevés, azt a fluorit még az oktaéder szerint összenőtt vagy inkább ikerkristályaival is elkápráztathatja.
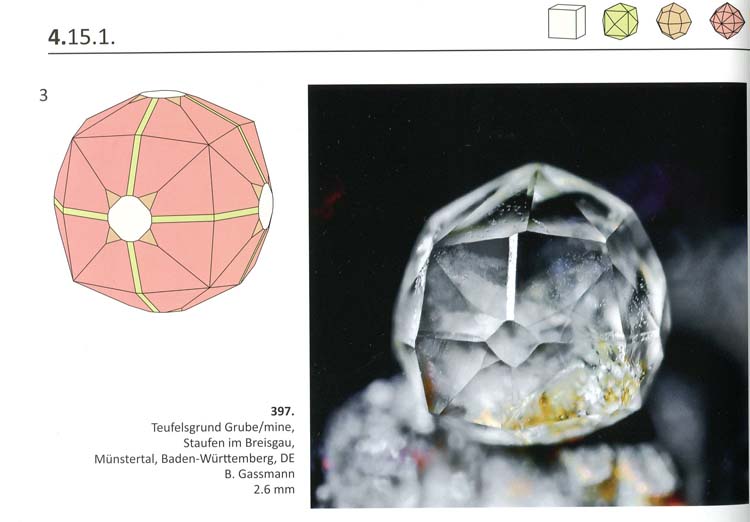
Fluorit kristálykombináció a valóságban és idealizált rajzon Eddy Van Der Meersche Kristallformen von Fluorit / Crystal Forms of Fluorite c. könyvéből (2014).
A minuciózus francia, a röntgenszemű angolok és a fluorit
A fluorit formagazdag, szabályos kristályai természetesen az 1700-as évek végén kibontakozó kristálytan művelőit sem hagyták hidegen. René-Just Haüy francia mineralógus (1743–1822) egy letört kalcitkristály szemlélése nyomán felismerte, hogy a kalcit tetszőleges alakú kristályai egyforma idomokká (romboéderekké) hasíthatók szét. Ebből arra következtetett, hogy egy ásvány valamennyi kristályformája elméletben levezethető egy alapforma lapjaira lépcsőzetesen lerakódó egyre kisebb kristálylemezkékből (dekreszcencia-elv). A fluorit, mintha csak Haüy elképzelését akarná igazolni, gyakorta alkot a képen láthatóhoz hasonló „dekreszcens” kristályokat, ahol az oktaéder síkjait a kocka lépcsőzetesen kifejlett lapjai rajzolják ki. Hozzá kell ehhez tennünk, hogy Haüy, éppen megfordítva, a fluorit elemi formájának a hasadási idomot, az oktaédert választotta.
„Dekreszcens” fluorit és a kockákból felépülő oktaéder famodellje.
Bő egy évszázaddal később, 1914-ban a fluorit azon ásványok közé tartozott, amelynek szerkezetét a Max von Laue által 1912-ben felfedezett röntgendiffrakció jelenségét felhasználva elsőként határozták meg. Laue abból az ismert tényből indult ki, hogy egy kétdimenziós optikai rácson szóródó és interferáló fénysugár egy pontrácsból álló elhajlási képet ad. Mivel a röntgensugár hullámhosszát és a kristályokban feltételezett háromdimenziós rács periodicitását egyaránt 10–8 cm-re becsülte, azt feltételezte, hogy a különböző irányokból röntgensugárral megvilágított kristályok mögé helyezett filmeken is egy pontrács jelenhet meg – és így is történt. William Lawrence Bragg (1890–1971) és apja, William Henry Bragg (1862–1942) volt az, aki a jelenséget elsőként a kristályok belső szerkezetének meghatározásra használta fel (1913). A két Bragg korszakos munkájáért igen hamar, 1915-ben Nobel-díjat kapott. Azóta sem fordult még elő, hogy szülő és gyermeke ugyanakkor részesültek volna a díjban. A természettudományok terén az ifjabbik Bragg a maga 25 évével valószínűleg mindörökké a legfiatalabb nyertes marad (már ha eltekintünk Gorcsev Ivántól, aki – mint Rejtő Jenőtől tudjuk – 21 éves korában, viszont a makaó nevű kártyajátékon nyerte el a fizikai Nobel-díjat).

Balra: Fluoritkristályról a testátló irányából készült Laue-felvétel grafikus reprezentációja. Forrás: Bragg, W. L. (1913): The structure of some crystals as indicated by their diffraction of X-rays. – Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 89 (610): 248–277. Középen: William Henry Bragg, jobbra: William Lawrence Bragg. Forrás: https://www.innovation-intelligence.com/bios/braggs
Braggék korai „kísérleti alanyainak” többsége érthető módon szabályos szimmetriájú és egyszerű vegyi összetételű anyag volt, a kősó (NaCl), a gyémánt (C), illetve a hozzá igen hasonló szfalerit (ZnS), és a közeli rokon fluorit (CaF2), melyekről sejthető volt, hogy a szerkezetük viszonylag egyszerű lehet. Az elsőnek meghatározott szerkezeti típusok ezen ásványok nevét viselik azóta is, noha számos más ásvány vagy szintetikus vegyület is ugyanígy kristályosodik, fluoritrácsú például az uraninit (UO2), más néven uránszurokérc, az urán fő nyersanyaga is. Ha alaposabban megnézzük a fluorit szerkezetét, látható, hogy a fluoridionok (az anionok) négyes koordinációban ülnek egy-egy tetraéder közepén, melyeknek a csúcsait adják a kalciumionok (a kationok), ez utóbbiak viszont a fluoridionok alkotta kockák közepén találhatók nyolcas koordinációban. A fluoritrácsban az anionok sugara kisebb a kationokénál, az úgynevezett antifluoritrácsban, ahol az anionok nyolcas és a kationok négyes koordinációjúak, éppen fordítva, a kationok a nagyobbak. Jellegzetes antifluoritrácsú vegyületek az alkálifém-oxidok (Li2O, Na2O, K2O). A fluorit- és antifluoritrácsú anyagok között szerkezeti sajátosságaik miatt sok a jó ionvezető. Jelenleg is intenzíven kutatják őket az anyagtudományi szakemberek, hiszen a fluoridion akkumulátorokban elméletileg nagyobb energiasűrűség érhető el, mint a jelenlegi lítiumion akkumulátorokban.

A gyémánt (C), a szfalerit (ZnS) és a fluorit (CaF2) szerkezeti rokonsága. A gyémántrács alapegysége (elemi cellája) egy kocka, melynek minden csúcsán, lapközepén és minden második térnyolcadának közepén van egy (szén)atom. A szfaleritrács ettől csak annyiban tér el, hogy a kocka síkjaival párhuzamosan eltérő (cink és kén) atomsíkok váltakoznak. Ha pedig az üres közepű térnyolcadokat is kitöltjük a többi térnyolcadban lévővel azonos atommal, megkapjuk a fluoritrácsot. Forrás: Papp G. (2018): Az év ásványa, a fluorit (I.) Bűvös kockák a föld alól. – Élet és Tudomány, 73 (49): 1556–1559.
A fluorit a vegykonyhában…
Mineralógiai közhely, hogy egy ásvány meghatározó adatai a szerkezete és az összetétele. Az előbbivel már alaposan megismerkedtünk, és közben arról is szó esett, hogy a fluorit (elméleti) képlete CaF2. A fluorit tehát vegyileg fluorid, mégpedig az ipar legfőbb fluorforrása. Sőt, maga a kémiai elem is a fluorit ásványtól kölcsönözte a nevét, még azelőtt, hogy elemi formában előállították volna. A történet még az 1700-as évek fordulóján kezdődött, amikor I. Frigyes Ágost szász választófejedelem orvosa, Matthäus Pauli egy titkos receptet adott kollégájának, a goldingeni (ma Kuldiga, Litvánia) Johann Georg Weygandnak. Az 1725-ben a Breslauer Samlungen című tudományos folyóiratban megjelent írás szerint salétromsav és porított fluorit felhasználásával egy olyan erős szer állítható elő, amellyel mindenféle ábrákat lehet az üvegbe maratni. Andreas Sigismund Marggraf német vegyész az 1760-as években már tanulmányozta a fluorit és a kénsav reakcióját is, és azt találta, hogy a keletkező anyag megtámadja az üveget.
A svéd Carl Wilhelm Scheele ennek nyomán 1771-ben egy részletes tanulmányt szentelt a fluoritnak és a belőle nyerhető igen erős savnak, melyet a fluss-spats-syra, azaz folypátsav névvel illetett (ez később folysavra rövidült). Scheele még azt is felfedezte, hogy e savat mésszel reagáltatva a fluorittal egyező anyagot nyer. A folysav mibenléte körül jó ideig bizonytalanság honolt, míg a francia André-Marie Ampère be nem bizonyította, hogy a sósavhoz hasonlóan hidrogén és egy másik elem alkotja. Ezt közlése nyomán az angol Humphry Davy – a klór elemi mivoltának igazolója és elnevezője – is alátámasztotta vizsgálataival, és stílszerűen ő adta az elem általában használt fluor nevét is, 1813-ban megjelent cikke szerint Ampère sugallatára. Ampère 1816-ban különböző meggondolások alapján mégis inkább az ógörög fthoriosz (pusztító, romboló) szóból képzett ftor nevet javasolta, de ez a görögön kívül csak a keleti szláv nyelvekben terjedt el.

A fluor korai történetében szerepet játszó vegyészek , balról jobbra: Andreas Sigismund Marggraf (1709–1782), Carl Wilhelm Scheele (1742–1786), André-Marie Ampère (1775–1836), Humphry Davy (1778–1829). Forrás: Wikipédia
Magát az elemi fluort azonban sokáig hiába próbálták előállítani, noha több vegyész szenvedett balesetet, áldozta fel egészségét, sőt életét e cél elérésén dolgozva, lévén hogy mind a fluor, mind a hidrogén-fluorid erősen mérgező és rendkívül reakcióképes. Végül 1886-ban Henri Moissan francia vegyésznek sikerült tiszta fluorgázt előállítania KF és HF –23 °C-ra hűtött oldatának egy fluoritdugókkal lezárt U alakú platinacsőben, Pt-Ir elektródokon történő elektrolízisével. A fluorgázt ma is gyakorlatilag ezen eljárással nyerik, melyért Moissan 1906-ban Nobel-díjat kapott. Nagyobb mennyiségben a II. világháború óta gyártják, mint az urándúsítás nélkülözhetetlen kellékét, másik fő felhasználási területe a nagyfeszültségű elektromos megszakítók gáztölteteként alkalmazott kén-hexafluorid előállítása.

Henri Moissan (1852–1907) és elektrolitikai berendezése, mellyel a fluorgázt előállította. Forrás: Wikipedia
Létezik egyébként olyan fluorit, mely Pandora szelencéjeként magában zárva őrzi az elemi fluorgázt. Erre az ásvány összetörésekor észlelhető jellegzetes szúrós szag utal, ami miatt a német bányászok a személetes Stinkspat (büdöspát) névvel tisztelték meg az ásványt – nemcsak bűvös, hanem büdös kockák is léteznek tehát. A finomabb lelkű mineralógusok antozonitra keresztelték el, abban a hitben, hogy az ózon ellentétét képviselő ant(i)ózon gáz szabadul fel belőle. Valójában az ásványban a benne lévő – és a sugárzással létrehozott színcentrumokkal a nagyon sötét színt is okozó – radioaktív zárványok miatt fluorgáz keletkezik, és az ásványt összetörve a légköri oxigénnel és vízgőzzel reagálva ózont és hidrogénfluoridot produkál.

Az antozonit nevű fluoritváltozat. Forrás: Wikipédia (Didier Descouens)
…és a fluor a konyhában
A háztartásokban is lépten-nyomon megtalálható fluorvegyületek kiinduló anyaga a fluorsav. Ezt egyedül Európában évi 200-250.000 tonnás nagyságrendben állítják elő a klasszikus eljárással, fluorit és kénsav reakciójából; 1 tonna végtermékhez kb. 2 tonna fluorit szükséges. Magát a fluorsavat is használják a mikroelektronikai iparban maratásra és tisztításra, illetve katalizátornak a kőolajfinomítás egyik lépcsőjében, valamint a mosószergyártásnál vagy éppen a kristályüveg végkezelésénél, de a belőle előállított fluorvegyületek alkalmazása jóval kiterjedtebb. A fluorokarbon gázokat – így a freon márkanéven elhíresült, ma már betiltott klórfluorokarbonokat (CFC) – hűtőközegnek, sprayhajtógáznak, valamint műanyaghabok előállítása során használják. A szintén környezetvédelmi aggályokat kiváltó fluorpolimer műanyagokat is megleljük a konyhában, gondoljunk csak a Teflon márkanévvel jelölt bevonatokra, de ha kimegyünk a szabadba, Gore-Tex márkanevű és más bevonatok vagy akár horgászzsinór képében találkozhatunk velük. A kerámia- és üvegiparban különböző fluoridokat használnak folyósítóanyagként és zománcadalékként. Az alumíniumkohászatban olvadáspont-csökkenőként és egyben elektrolitként használt fluoridot, a kriolitot (NaAlF3) a világon egyetlen helyen bányászták (Ivittuut, Grönland, 1865–1987), ma már a szintetikus műkriolit és további fluoridok (BaF2, AlF3) léptek a helyére.

C10F21 képletű fluoropolimerlánc idalizált rajza, a szürke: szén, a zöld: fluor. Forrás: Wikipédia (Ben Mills)
A fluor talán legismertebb – és leginkább testközeli – alkalmazása a fogrémekben, a fluortablettákban és (főleg az USA-ban) a fluorozott ivóvízben van. A fogzománcban lévő bioásvány ugyanis jobban ellenáll a fogszuvasodásnak, ha a hidroxilapatitéhoz – Ca5(PO4)3(OH) – hasonló összetételében a hidroxilt fluoridra cseréljük. A fluor alkalmazásának mikéntje és hasznai körül viták zajlanak, mindesetre a fogzománcba beépülő fluor kedvező hatása bizonyítottnak tűnik, mint ahogy az is, hogy túladagolása ártalmas a fogaknak (fluorózis) és a szervezetnek is.
A folypát – miért foly és mitől pát?
Láttuk, hogy a fluorit sok mindennek kölcsönözte nevét – de végül is honnan eredt az ő neve? Az etimológia az ásvány másik fő felhasználási területével kapcsolatos. Agricola (Georg Bauer) műveiből tudjuk, hogy a középkori német bányászok a vaskohászatban salakfolyósító adalékként használt ásványt a folyékony állapotú anyagot is jelentő Fluß névvel illették. A mai ásványnevet a hasonló jelentésű – és Agricola által is az ásvány latin neveként használt – fluor szóból alkották meg 1797-ben. A többek között a hőveszteség csökkentésére, a nem kívánatos alkotórészek leválasztására és a kemencefalazat védelmére is szolgáló salakot csapolással a legkönnyebb eltávolítani a kemencéből, ezért az érchez különféle olvadáspont-csökkentő anyagokat adnak. Ezek egyike ma is a fluorit, melyből 1 tonna acél előállításához az eljárástól függően 2-6 kg-ot használnak föl, a salakfolyósítás mellett az olvadék kéntartalmának lekötésére is.
Metallurgiai fluorit salakfolyósító adalék reklámja a netről
A később általánosan használt német Flußspat bányászati terminust más nyelvek is átvették, az angol például fluorspar, a magyar folypát alakban. A Spat, spar és pát végződés a jól hasadó ásványokat jelölte a régi ásványnevekben – mint a földpát, mészpát (kalcit) vagy súlypát (barit) esetében is. (A szócska egy hosszú lapos fadarabot jelentő – és az orvosi spatula nevében is megbújó – régi indogermán gyökből származik.) A fluorit valóban kitűnően hasad, mégpedig az oktaéder síkjai szerint, ami a tömeges megjelenésű példányok határfelületein jól látszik, de a fenn-nőtt kristályok belsejében is megjelenhet – olykor irizálva becsillanó – tükröző felületekként. Az ásványbörzéken olcsó pénzért vásárolható szabad oktaédereket sem kristálylapok, hanem hasadási lapok határolják. A tetszetős hasadási idomokat ügyes kezű kínaiak hasítják ki a tömeges fluoritból. A fluoritot jó hasadása és gyakorisága predesztinálta arra, hogy Friedrich Mohs az ásványtani (karc)keménységi skála egyik tagjának, éspedig a negyedik keménységi fokozatnak válassza.

Fluorit hasadási oktaéderei
Érdekes adalék, hogy a Pákozd melletti telérre, melyből 1952–1961 között csaknem 20.000 tonna nyers fluoritot termeltek, az ásvány jó hasadása révén figyelt fel a területen térképező geológus, Jantsky Béla. Miközben egy 1951. augusztus végi délutánon egy kvarcos telért követett, szemét vakító fénysugár ütötte meg, mely az előzőleg ott gyakorlatozó szovjet tankok által széttört sziklák egyikéről, egy tenyérnyi hasadási lapról tükröződött. Jól tudva, hogy a kvarc nem hasad, Jantsky izgatottan végigkalapálta a telért, és megtalálta az értékes nyersanyagot, amit korábban senki sem vett észre, hiszen a napfényen színét vesztett fluorit vajmi kevéssé ütött el a gránitban húzódó fehér kvarcerektől.
A fluorit világtermelése 1913 és 2023 között. A termelési adatok forrása: United States Geological Survey, Mineral Commodity Reports.
Az eddigiek alapján nem lehet meglepő, hogy a fluorit fontos ipari ásvány, szakszóval élve nemérces nyersanyag. Az I. világháború előtti (1913) 170.000 tonnás világtermelés a II. világháború előtt (1938) 460.000 t-ra nőtt. A háborús csúcsot (1 millió t, 1943-44) követő átmeneti visszaesés után az 1950-es évek elején meghaladta az egy, tíz év múlva a két, újabb tíz év múlva a négy millió tonnát, a 4,5-5 millió tonnás szinten stabilizálódott, majd az 1990-es évek visszaesése után, melyet a CFC-gázok betiltása és a kohászati felhasználás csökkenése okozott, 8 millió tonna fölé emelkedett. (A magyar fluorittermelés 1952–1967 között összesen 32.000 t nyers fluorit volt.) A fő termelők Kína, Mexikó, Mongólia, Dél-Afrika és Vietnam. A termelés 2/3-át a vegyipar, ¼-ét a vaskohászat hasznosítja. Számottevő még az alumíniumkohászat fluoritfogyasztása is. A speciális felhasználási területek közül érdekességként említjük meg a (mesterségesen előállított) fluorit optikai alkalmazását, főként távcsövekben és speciális objektívekben. A fluoritnak ugyanis számos előnyös optikai tulajdonsága van, így nem csoda, hogy egy távcsöves blogban „az optika Szent Grálja” gyanánt említették. A vörösön inneni és az ibolyán túli tartományban is jó áteresztőképességű, nem kettőstörő és kicsi a diszperziója (a fénytörése kevéssé függ a fény hullámhosszától, tehát a belőle csiszolt lencsének kicsi a kromatikus hibája).

Balra természetese, középen mesterséges fluorit, a belőle kivágott korongokkal és az ezekből csiszolt lencsével. Forrás: Canon Hungaria (https://www.canon.hu/pro/infobank/fluorite-aspherical-ud-lenses/)
Színek világosban és sötétben…
A színtelen optikai fluorit dicsérete után térjünk át a színes változatok méltatására, hiszen annak dacára, hogy a vegytiszta kalcium-fluorid színtelen, a fluorit a leginkább sokszínű ásványok közé tartozik. A színek kavalkádját többnyire a Ca helyére igen kis mennyiségben beépülő „idegen” elemek – leginkább ritkaföldfémek – adják, melyek ionizáló sugárzás hatására a látható fény által gerjeszthető színcentrumokat hoznak létre, de „színező elem” lehet a sugárzás hatására kolloidális eloszlásban felszabaduló kalcium is. Mint több más allokróm (idegen színű) ásvány esetében, a növekedése során megváltozott viszonyok miatt a kristály különböző zónái más összetételűek – és ezért más színűek – lehetnek. Nem mentes a fluorit az allokróm ásványok azon sajátságától sem, hogy megvilágítás hatására színe megváltozhat vagy kifakulhat, ha olyan színcentrumok vannak benn, melyeket a látható fénye energiája is módosít. Sajnos a velencei-hegységi fluorit színe sem stabil. Érdekes viszont, hogy bár az allokróm ásványok – lévén hogy poruk fehér – pigmentnek igazából nem alkalmasak, az igen sötét lila fluorit durva őrleményét megtalálták régi festmények rózsaszín, illetve lilás színű részletein.

Zónás színezésű fluorit.
Számos fluoritban vannak ibolyántúli (UV-) fénnyel gerjeszthető színcentrumok. E példányok UV-lámpával megvilágítva változatos színekben világítanak. Bár az UV-lumineszcencia sötétben észlelhető a legjobban, olyan erőteljes lehet, hogy napfényben – annak ibolyántúli összetevője hatására – az ásvány határozottan eltérő színt mutat, mint mesterséges fényben. Ez tette lehetővé, hogy a fluorit fotolumineszcenciáját még jóval az UV-lámpák kora előtt felfedezzék. A lumineszcencia e válfaját, amikor az anyag fény (vagy egyéb elektromágneseses sugárzás) hatására bocsájt ki fényt, George Gabriel Stokes brit tudós nevezte el az ásványról fluoreszcenciának 1858-ban. (Az igazsághoz hozzátartozik, hogy az effektust már 1560-ban leírták egy közép-amerikai fafajból készült vizelethajtó ital esetében, de ez egy idő után feledésbe merült.). Egyes fluoritok esetében hosszabb-rövidebb utóvilágítás, azaz foszforeszcencia is észlelhető.

A kiállításunkon bemutatott fluorit látható (neon-), kevert (neon- és UV-) és láthatatlan ibolyántúli fényben.
…valamint melegben
Régóta tudott, hogy a tárgyak nemcsak megvilágítás, hanem például hő hatására is fényt bocsájthatnak ki jóval az izzás hőmérséklete alatt. A jelenséget először (1673) Robert Boyle angol fizikus és vegyész említette a gyémánt esetében, de már 1676-ban megjelent az első leírás a fluorit termolumineszcenciájáról is Johann Sigismund Elsholtz tollából. Az ásványt a német természetbúvár zöldes lumineszcens színhatása miatt „phosphorus smaragdinus” névvel illette, ami az egyik erős zöld termolumineszcenciájáról híres, amúgy lila fluoritváltozatnak 219 évvel később adott pirosmaragd névben köszönt vissza. A jelenséget egy hagyományos villanyrezsó alkalmazásával bárki kipróbálhatja, de a hő hatásra esetleg felrobbanó fluorit szilánkjai miatt csak kellő óvatossággal és védőszemüveg használata mellett!

Villanyrezsóra helyezett fluorit hasadási idomok termolumineszcenciája.
Az egykor megfizethetetlen, ma megfizethető drágakő
A fluorit szép és változatos színei miatt adódik a kérdés, miért nem találkozhatunk vele az ékszerészeknél? Nos, bár a fazettázott (lapra csiszolt) fluorit tetszetős, a fentebb említett puhasága miatt ékkőként nem igazán használható, mert fényét hamar elveszti, ráadásul viszonylag kicsi a fénytörése is (fluorit 1,43, berill 1,57–1,60, korund 1,76–1,77, gyémánt 2,42). Ennek ellenére egykor drágakő-utánzatként is használták, innen az egyes színváltozatok kevéssé hízelgő régi kereskedelmi neve: „hamis smaragd” vagy „csehsmaragd” (zöld), „hamis topáz” (sárga), „hamis ametiszt” (lila). Olcsóbb ékszerekben (nyaklánc, függő) azonban ma is megtalálható gömbölyűre csiszolva, akár fényesre polírozva, akár matt felülettel. Hordó alakúra csiszolt, nyakláncokban és karkötőkben viselt fluoritgyöngyök a X–XII. századi – elsősorban fiatal női (ill. gyermek-) – sírok elterjedt sírmellékletei a Kárpát-medencében, Erdélyt kivéve. A Dunántúlon különösen gyakoriak, a Kárpát-medencén kívül pedig a főbb távolsági kereskedelmi és sószállító utak mentén mutathatók ki (Ritoók Ágnes szíves közlése nyomán). E „honfoglalás-kori bizsuk” lila fluoritgyöngyei egyébként olykor megtévesztették az ásványtanban járatlan régészeket is, számos lelet régebben ametiszt gyanánt szerepelt a publikációkban. Fluoritból készült pecsétek, ékszerek, idolok, szobrocskák ismeretesek például Görögországból a minószi civilizáció egyes periódusaiból (Kr. e. 1700–1300 körül), Egyiptomból a Ptolemaidák korából (Kr. e. 305–30), Észak-Amerikából a Mississippi-kultúrából (kb. 800–1600).

Fazettázott fluoritok a „Rocks and Minerals” folyóirat egyik cikkének címlapfotójaként. Forrás: Mauthner, M. (2020): Faceted fluorites. – Rocks and Minerals, 95 (4): 357–361. (https://www.tandfonline.com/doi/abs/10.1080/00357529.2020.1744096)

Fluoritgyöngyöket tartalmazó gyöngysor a Magyar Nemzeti Múzeum zalavári ásatásából (Ritoók Ágnes szívessége).
Ha a kőzetrepedésekben ereket vagy teléreket alkotó fluorit színe a telér kitöltődése során ritmikusan változik, egyszerű ipari ásványból díszítőkő-nyersanyaggá avanzsál. Sok művészettörténész szerint fluorit volt az a Plinius által is említett sokszínű, rendkívül értékes drágakő, amelyből a vasa murrhina nevű ivóedények készültek, Egy három sextertiusos (kb. 1,5 l) kupáért állítólag 70 talentum (kb. 210 kg) ezüstöt is megadtak. Bár az ónix, a sávozott üveg, sőt a kínai porcelán is a lehetséges nyersanyagok között van, a fluorit mellett szól a British Museumban lévő két római kori fluoritedény, a Barber- és a Crawford-kupa is. Ha megnéztük ezeket, Londontól alig 230 km-re Castleton (Derbyshire) meglátogathatjuk a másik híres sávos fluorit, a Blue John lelőhelyét. A „Kék János” jelentésű név valószínűleg az ásvány lila és sárga sávjaira utaló francia bleu jaune angollá torzulásából alakult ki, bár a cornwalli bleujenn (virág) is „gyanúsított”. Annyi bizonyos, hogy az 1700-as évek közepe óta bányásszák, és különösen az 1800-as években volt divatos, késnyelektől dobozokon át kelyhekig, sőt mozaikokig sok mindenre felhasználták. Manapság hosszas szárítás után az óvatosan hevített nyersanyagot vákuumban műgyantával itatják át, hogy jobban bírja a darabolás és csiszolás mechanikai megpróbáltatásait. Legújabban, mint annyi minden, a szép sávos fluorit is Kínából érkezik a drágakőpiacra.

Sávos színezésű tömeges fluorittelérek („Blue John”) típusai az anglia Derbyshire vidékről. Forrás: https://bluejohngallery.co.uk/pages/derbyshire-blue-john-veins

„Blue John”-ból készült dísztárgyak. Forrás: Wikipédia
Telérek, testek, kockák és kombinációk
A fluorit gránitos és más, ritkább kőzetekben mellékes kőzetalkotó elegyrész is lehet, de a gazdaságilag hasznosítható előfordulások a hidrotermás (forróvizes) keletkezésű telérek (hazánkban a Velencei-hegységben) és nagy vastagságú üledékes kőzetsorozatok felsőbb régióiból aránylag kis hőmérsékletű sós fluidumok által kioldott, majd a leszivárgó oldatok által egy adott rétegtani szintben a helyi geokémiai tényezők hatására lerakott lapos, lencseszerű testek. Magyarországon a Velencei-hegységi egykori fluoritbányák környékén még mindig találhatunk tömeges, illetve az elvétve található üregekben kocka alakú kristályokat (ajánlatos UV-lámpával keresgélni). Nagyobb szerencse kell a Budapest környéki üledékes kőzetekben található kalcitos telérek, illetve a Mátra érces kvarctelérek üregeiben olykor felbukkanó, néha szépen színezett és lapokban gazdagabb kombinációkat alkotó, néhány mm-es, ritkán 1-2 cm-es fluoritkristálykák megtalálásához. Az érdeklődő a Geománia internetes oldalon találhat bővebb útbaigazítást (www.geomania.hu).

Fluorit, Gyöngyösoroszi, altáró (Tóth László szívessége)
E blogcikk a fluoritnak az Év ásványává választása alkalmából készült, az Élet és Tudományban 2018-ban megjelentetett írások – Papp G. (2018): Az év ásványa, a fluorit (I.) Bűvös kockák a föld alól. – Élet és Tudomány, 73 (49): 1556–1559. és Papp G. (2018): Az év ásványa, a fluorit (II.) Egy ásvány – két arc: Szürke iparos és sokszínű drágakő. – Élet és Tudomány, 73 (50): 1577–1579. – néhol módosított és kiegészített változata.

A témához tartozó korábbi blogcikkeink:
https://mttmuzeum.blog.hu/2018/05/31/a_fluorit_szinek_formak_tortenetek
https://mttmuzeum.blog.hu/2018/12/30/asvanygyujtes_este_avagy_latnivalok_a_sotetben
https://mttmuzeum.blog.hu/2018/12/31/fluorit_a_rezson_avagy_termolumineszcencia_a_konyhaban
A bejegyzés trackback címe:
Kommentek:
A hozzászólások a vonatkozó jogszabályok értelmében felhasználói tartalomnak minősülnek, értük a szolgáltatás technikai üzemeltetője semmilyen felelősséget nem vállal, azokat nem ellenőrzi. Kifogás esetén forduljon a blog szerkesztőjéhez. Részletek a Felhasználási feltételekben és az adatvédelmi tájékoztatóban.










